Это лекарство произвело фурор и на долгое время стало панацеей от многих заболеваний. Медицина не стоит на месте, как и болезни. Необходимо разрабатывать и производить все новые виды антибиотиков.
Иначе прежние потеряют нынешнюю эффективность.
Что такое антибиотики?
Весна — время простудных заболеваний, поэтому многие из нас держат в аптечке упаковку антибиотиков «на всякий случай». Согласно опросу ВЦИОМ за 2011 год 48% женщин и 43% мужчин, а это почти половина россиян, считают, что вирусы, так же, как и бактерии, неустойчивы к антибиотикам.
Давайте же разберемся, что за зверь такой этот антибиотик, и для кого он опасен.

Для начала обратимся к термину «микробиология». Микробиология — это наука, предметом изучения которой являются микроскопические организмы, их строение, взаимоотношения и все остальное, связанное с ними, что можно изучить. Теперь перейдем к более узкому понятию — бактериологии. Что она изучает, думаю, и так понятно.
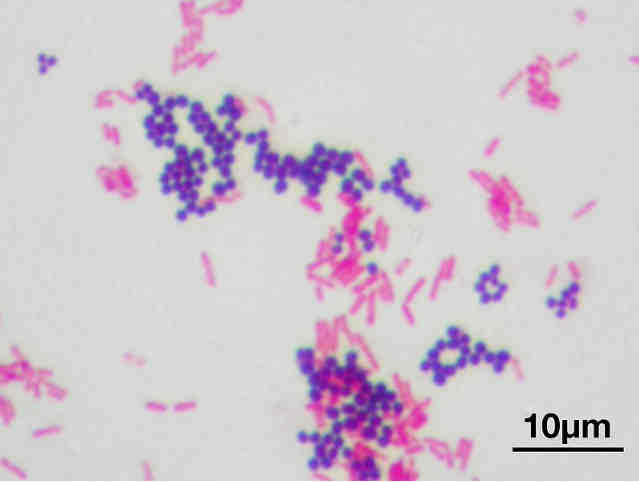
Бактерии, как и протисты (более сложно устроенные микроорганизмы), состоят из одной клетки и являются самостоятельными жизнеспособными организмами. Хотя для них свойственно образовывать скопления — колонии, которые, кстати, вполне могут быть видны невооруженным глазом.
На фото чашка Петри с разросшимися на ней бактериями, собранные на одной из станций Питерского метро.
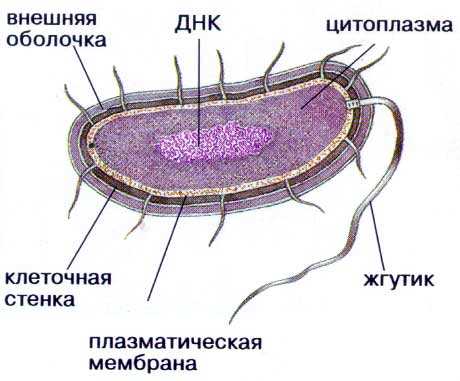
Бактерии не имеют оформленного ядра и органелл, которые выполняли бы все функции (аналог наших органов, если можно так выразиться). Их еще называют прокариотами (доядерными организмами), а тех, кто имеет ядра — эукариотами (к которым относимся и мы).
Все, из чего состоит бактерия:
- — протопласт — цитоплазма (все внутренне содержимое клетки) и покрывающая сверху мембрана
- — клеточная стенка, вокруг которой может быть слизистый чехол и/или капсула
- — могут быть жгутики для передвижения
Все, кто дочитал до этого места, могут задать справедливый вопрос:
«А причем тут вообще антибиотики?».
Так вот, антибиотики — вещества, обладающие бактерицидной активностью. Как было сказано выше, от вирусов они не помогут, как и от простейших. Но это скорее исключение.
Теперь же давайте разбираться, почему они действуют именно на бактерии и как именно.
Механизмы действия:
Самый первый из изученных
Воздействие на клеточную стенку.
По своему химическому составу клеточная стенка бактерий отличается от клеточной стенки эукариот. Основной компонент — муреин, который образует на поверхности муреиновую сеть.
Датский микробиолог Ганс Грам предложил способ окраски мазков бактерий, названный потом в его честь. Мазок окрашивался генцианвиолетом (краситель) и закрепляется раствором иода. Дальше уже бактерии ведут себя по-разному, из-за чего их разделили на две группы: те, у кого краситель удерживается в клетке при обработке спиртом или ацетоном (грамположительные), и те, кто обесцвечиваются (грамотрицательные).
Staphylococcus aureus — золотистый стафилококк (грамположительные кокки, темные) и Escherichia coli — кишечная палочка (грамотрицательные бациллы, розовые).
Очевидно - из картинки внизу.
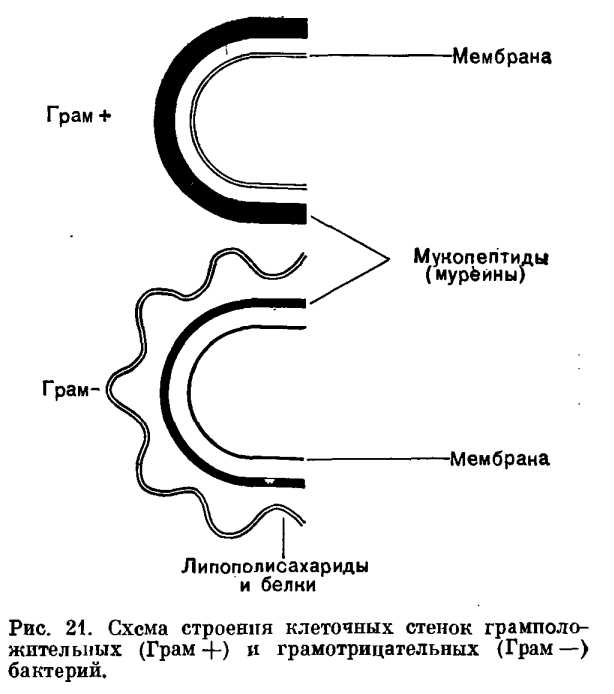
Стенка выполняет барьерную функцию и устанавливает контакт бактерии с окружающей средой. Грамотрицательные бактерии — более высокая ступень эволюции, они более устойчивы в токсинам, в том числе и антибиотикам, чем грамположительные, хотя те и имеют более толстую (и в то же время более уязвимую) стенку.
Некоторые антибиотики (группа пенициллина и циклосерина) подавляют синтез клеточной стенки, что приводит к образованию протопластов (см. выше) и сферопластов (клеточная стенка разрушена, но не до конца). При прекращении приема антибиотиков они снова реверсируют (превращаются) в нормальные клетки или трансформируются в L-формы, но могут и погибнуть.
L-формы не имеют клеточной стенки, но могут развиваться, расти и делиться. Образование L-форм — одна из причин хронических рецидивирующих заболеваний. При неправильном приеме антибиотиков состояние больного может улучшиться, но после полной отмены происходит реверсия до полноценных форм исходного вида с восстановлением их патогенности. Кстати, может еще и появиться иммунитет к этим антибиотикам, что значит, что при рецидиве они не помогут.
Чтобы понять, почему прием антибиотиков имеет ту или иную дозировку, стоит посмотреть на этот график:
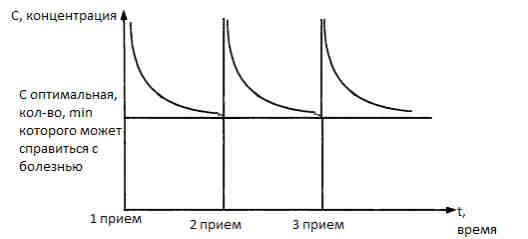
Концентрация вначале всегда выше оптимальной, но со временем выводится из организма, поэтому необходимо принимать таблетки снова. И поэтому важно подобрать антибиотики, в которых их эффективность была бы сильнее или хотя бы на уровне с возможными рисками и побочными эффектами.
Что не так с антибиотиками? А что не так с нами? Вы же знаете, что при простуде или гриппе или любом другом вирусном заболевании принимать антибиотики бессмысленно и весьма недальновидно?
Именно таким способом антибиотики влияют на представителей крупозной и очаговой пневмонии, менингита, инфекций мочевыводящих и желчных путей, сифилиса, гонореи, дифтерии, скарлатины, ангины, ЛОР-заболеваний и многих других.
- Другой механизм воздействия — нарушение синтеза белка в клетке: ингибирование (подавление) функций рибосом и синтеза белка (стрептомицин). Лечат туберкулез легких и других органов, бруцеллез, чума.
- Нарушение целостности мембран, т. е. нарушение ионных каналов, что может сделать клетку проницаемой для веществ, которые внутрь попадать не должны, или наоборот — заблокировать доступ важных веществ. (грамицидин, полимиксин). Используют при заболеваниях желудочно-кишечного тракта, сепсиса, и, как и пенициллин, при менингите и ЛОР-заболеваниях.
- Угнетение синтеза нуклеиновых кислот (ДНК и РНК) за счет нарушения работы ферментов, которые «руководят» процессом. При лейкозе, лимфоме, лимфосаркоме, нейлобластоме у детей. Применяется вместе с другими противоопухолевыми препаратами.
- Нарушение синтеза ДНК и РНК, но за счет нарушения самих азотистых оснований — компонентов непосредственно самих нуклеиновых кислот (саркомицин). Подавляет рост культуры клеток рака Эрлиха.
- Ну и напоследок, ингибирование дыхательных ферментов бактерий (антимицин). Используется в растениеводстве для уничтожение грибов-вредителей сельского хозяйства.
Теперь стоит обсудить такую вещь как антибиотикорезистентность, т. е. устойчивость микроорганизма к действию антибиотика. Может возникать из-за мутаций и после воздействия антибиотика закрепляться у всей группы организмов.
Механизмы противостояния:
- блокирование входа в клетку — дополнительная мембрана у большинства грамотрицательных бактерий, что делает их невосприимчивыми к пенициллину.
- уменьшение размера пор (антибиотик не проходит внутрь) или появляется белок, который сразу же выводит антибиотик из клетки.
- некоторые бактерии научились инактивировать антибиотики. Например, у стафилококков (р. Staphylococcus) вырабатывается для этого вещество β-лактоназа, которое разрушает β-лактамовое кольцо у большинства пенициллинов. Для этого в них добавляют фолиевую кислоту, чтобы подавлять β-лактоназу.
- Ну и может отсутствовать сама клеточная стенка, на которую воздействует антибиотик, как, например, род микоплазма (Mycoplasma)
Почему антибиотики бессильны против вирусов?
То, что антибиотики неэффективны против вирусов, уже давно стало азбучной истиной. Однако, как показывают опросы, 46% наших соотечественников полагают, что вирусы можно убить антибиотиками.
 Пенициллин — первый антибиотик — полученный на основе продуктов жизнедеятельности микроорганизмов.
Пенициллин — первый антибиотик — полученный на основе продуктов жизнедеятельности микроорганизмов.
На клеточную стенку действуют бета-лактамные антибиотики, к которым относятся пенициллины, цефалоспорины и другие; полимиксины нарушают целостность мембраны бактериальной клетки.
Клеточная стенка бактерий состоит из гетерополимерных нитей, сшитых между собой короткими пептидными мостиками.
Действие пенициллина на кишечную палочку: из-за пенициллина растущая бактериальная клетка не может достраивать клеточную стенку, которая перестаёт покрывать клетку целиком, в результате чего клеточная мембрана начинает выпячиваться и рваться.
У многих вирусов кроме генома в виде ДНК или РНК и белкового капсида есть ещё дополнительная оболочка, или суперкапсид, которая состоит из фрагментов хозяйских клеточных мембран (фосфолипидов и белков) и удерживает на себе вирусные гликопротеины.
Какие слабые места антибиотики находят у бактерий?
Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.)
 Оказывается, фарм-компании идут на всё, чтобы получить прибыль (вот это новость, да?)
Оказывается, фарм-компании идут на всё, чтобы получить прибыль (вот это новость, да?)
наследственной молекулы ДНК, которую можно было бы отдать клетке-потомку. Над этой второй копией работают специальные белки, отвечающие за репликацию, то есть за удвоение ДНК. Для синтеза ДНК нужен «стройматериал», то есть азотистые основания, из которых ДНК состоит и которые складываются в ней в «слова» генетического кода. Синтезом оснований-кирпичиков опять же занимаются специализированные белки.
Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно.
Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей.
Большинство антибиотиков в борьбе с бактериями «атакуют» одну из этих трёх главных мишеней — клеточную стенку, синтез ДНК и синтез белка в бактериях.
Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном.
Почему же антибиотики не действуют на вирусы?
Во-первых, вспомним, что вирус — это, грубо говоря, белковая капсула с нуклеиновой кислотой внутри.
Она несёт в себе наследственную информацию в виде нескольких генов, которые защищены от внешней среды белками вирусной оболочки. Во-вторых, для размножения вирусы выбрали особенную стратегию. Каждый из них стремится создать как можно больше новых вирусных частиц, которые будут снабжены копиями генетической молекулы «родительской» частицы.
Словосочетание «генетическая молекула» использовано не случайно, так как среди молекул-хранительниц генетического материала у вирусов можно найти не только ДНК, но и РНК, причём и та и другая могут быть у них как одно-, так и двухцепочечными. Но так или иначе вирусам, как и бактериям, как и вообще всем живым существам, для начала нужно свою генетическую молекулу размножить. Вот для этого вирус пробирается в клетку.
Что он там делает?
Заставляет молекулярную машину клетки обслуживать его, вируса, генетический материал.
То есть клеточные молекулы и надмолекулярные комплексы, все эти рибосомы, ферменты синтеза нуклеиновых кислот и т. д. начинают копировать вирусный геном и синтезировать вирусные белки. Не будем вдаваться в подробности, как именно разные вирусы проникают в клетку, что за процессы происходят с их ДНК или РНК и как идёт сборка вирусных частиц. Важно, что вирусы зависят от клеточных молекулярных машин и особенно — от белоксинтезирующего «конвейера». Бактерии, даже если проникают в клетку, свои белки и нуклеиновые кислоты синтезируют себе сами.
 Анальгетик, обезболивающее — лекарственное средство природного, полусинтетического и синтетического происхождения, предназначенное для снятия болевых ощущен
Анальгетик, обезболивающее — лекарственное средство природного, полусинтетического и синтетического происхождения, предназначенное для снятия болевых ощущенНикакой клеточной стенки у вирусов нет.
И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает.
Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка?
Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет.
Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы.
Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию.
До какой степени может проявляться специализация антибиотиков?
Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками.
Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды.
Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов.
Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии).
Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает.
Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль.
Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии.
Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой.
Вирусы не во всём полагаются на клеточные ферменты.
Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК.
Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки.
Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии.
Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет.
Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики.
Однако надо сделать пару уточнений.
На самом деле бывает, что при вирусной простуде врачи рекомендуют принимать антибиотики, но это связано с тем, что вирусная инфекция осложняется бактериальной, с теми же симптомами.
Так что антибиотики тут нужны, но не для того, чтобы избавиться от вирусов, а для того, чтобы избавиться от «зашедших на огонёк» бактерий. Кроме того, говоря об антибиотиках, подавляющих биосинтез белка, мы упирали на то, что такие антибиотики могут взаимодействовать только с бактериальными молекулярными машинами. Но, например, тетрациклиновые антибиотики активно подавляют работу и эукариотических рибосом тоже.
Однако на наши клетки тетрациклины всё равно не действуют — из-за того, что не могут проникнуть сквозь клеточную мембрану (хотя бактериальная мембрана и клеточная стенка для них вполне проницаемы). Отдельные антибиотики, например пуромицин, действуют не только на бактерии, но и на инфекционных амёб, червей-паразитов и некоторые опухолевые клетки.
Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен.
И второе уточнение, вытекающее из первого: может ли такая «неразборчивость» или, лучше сказать, широкая специализация антибиотиков лежать в основе побочных эффектов от них?
На самом деле такие эффекты возникают не столько оттого, что антибиотики действуют на человека так же, как на бактерии, сколько оттого, что у антибиотиков обнаруживаются новые, неожиданные свойства, с их основной работой никак не связанные.
Например, пенициллин и некоторые другие бета-лактамные антибиотики плохо действует на нейроны — а всё потому, что они похожи на молекулу ГАМК (гамма-аминомасляной кислоты), одного из основных нейромедиаторов. Нейромедиа-торы нужны для связи между нейронами, и добавка антибиотиков может привести к нежелательным эффектам, как если бы в нервной системе образовался избыток этих самых нейромедиаторов. В частности, некоторые из антибиотиков, как считается, могут провоцировать эпилептические припадки.
Вообще, очень многие антибиотики взаимодействуют с нервными клетками, и часто такое взаимодействие приводит к негативному эффекту.
И одними лишь нервными клетками дело не ограничивается: антибиотик неомицин, например, если попадает в кровь, сильно вредит почкам (к счастью, он почти не всасывается из желудочно-кишечного тракта, так что при приёме перорально, то есть через рот, не наносит никакого ущерба, кроме как кишечным бактериям).
Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре.
Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор.
Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента.
Похожие публикации
Рак: узнать и победить

Можно ли заболеть раком, если в семье уже был прецедент? Существует ли вирус рака, и почему вакцины от одного вида рака существуют, а от другого - нет? Есть ли способ не заболеть, и как помочь себе… Открыть
Медицинские мифы

Некоторые медицинские мифы настолько укоренились в сознании, что воспринимаются как аксиомы. Открыть

Об информационной составляющей Отечественной войны 1812 года. Открыть
Принц крови - он убивает родных, тратит миллиарды и скоро станет королем

Приказ о жестоком убийстве саудовского журналиста и оппозиционера Джамаля Хашкуджи — которого, по предварительным данным, расчленили и чуть ли не растворили в кислоте… Открыть
Бомбардировка Дрездена

Бомбардировка Дрездена - серия бомбардировок немецкого города Дрезден, осуществлённых Королевскими военно-воздушными силами Великобритании и Военно-воздушными силами США 13-15 февраля 1945 года во время… Открыть